
Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
Malformazione arterovenosa
Esperto medico dell'articolo
Ultima recensione: 04.07.2025
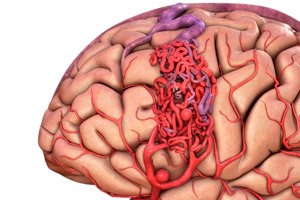
La malformazione artero-venosa è un difetto congenito nello sviluppo dei vasi sanguigni, caratterizzato dalla presenza di una rete anomala di anastomosi artero-venose. Nella maggior parte dei casi, le malformazioni artero-venose si localizzano nella fossa cranica posteriore e presentano una struttura piuttosto tipica: una o due arterie vere e proprie, un groviglio di MAV e una vena drenante.
 [ 1 ]
[ 1 ]
Le cause malformazione arterovenosa
Le cause che possono essere alla base dello sviluppo di MAV non sono ancora del tutto note, ma si ritiene che possano essere correlate a fattori genetici e ambientali. Ecco alcune delle possibili cause che possono essere associate allo sviluppo di MAV:
- Fattori genetici: studi hanno dimostrato che alcuni pazienti con MAV hanno una storia familiare della condizione. Mutazioni genetiche potrebbero svolgere un ruolo nella formazione dell'anomalia vascolare.
- Difetti congeniti: anomalie vascolari congenite possono svilupparsi durante lo sviluppo embrionale. Queste possono essere dovute a errori nello sviluppo dei tessuti vascolari cerebrali.
- Fattori ambientali: alcuni studi hanno dimostrato un legame tra MAV e determinati fattori ambientali, come radiazioni o esposizione a sostanze tossiche durante la gravidanza. Tuttavia, questi legami non sono sempre confermati e non spiegano tutti i casi di MAV.
- Fattori regionali: in alcuni casi, l'AVM può essere associata a determinate aree geografiche o gruppi etnici, ma queste associazioni richiedono ulteriori studi.
Oltre a questi fattori che possono influenzare lo sviluppo delle MAV, è importante notare che si tratta di una condizione congenita e viene solitamente diagnosticata alla nascita o nella prima infanzia, sebbene i sintomi possano manifestarsi più tardi nella vita. Sono necessarie ulteriori ricerche per comprendere con precisione le cause e i meccanismi dello sviluppo delle MAV.
Patogenesi
La più pericolosa è la rottura delle pareti della malformazione, accompagnata da emorragia intracranica spontanea. Ciò si verifica perché il sangue misto circola nei vasi malformati sotto pressione, in prossimità delle arterie. Naturalmente, l'alta pressione porta allo stiramento dei vasi degenerati, a un aumento del loro volume e a un assottigliamento della parete. Alla fine, la rottura si verifica nel punto più sottile. Secondo dati statistici, ciò si verifica nel 42-60% dei pazienti con MAV. La mortalità alla prima rottura di MAV raggiunge il 12-15%. Nei restanti casi, il sanguinamento può ripetersi, senza alcuna periodicità. Abbiamo osservato un paziente che ha avuto undici emorragie intracraniche spontanee nell'arco di 8 anni. Un decorso relativamente "benigno" della rottura di MAV, rispetto alla rottura di aneurismi arteriosi, è spiegato dalle peculiarità dei disturbi emodinamici che si verificano dopo la rottura. È noto che la rottura di un aneurisma arterioso porta il più delle volte a un'emorragia subaracnoidea (ESA) e allo sviluppo di angiospasmo, che nei primi minuti ha una natura protettiva, contribuendo a fermare rapidamente l'emorragia, ma in seguito rappresenta un grave pericolo per la vita del paziente.
È l'angiospasmo che porta all'ischemia cerebrale e all'edema a determinare la gravità delle condizioni del paziente e la prognosi. Al contrario, l'angiospasmo delle arterie afferenti dell'AVM, al contrario, migliora l'afflusso di sangue al cervello grazie a una riduzione della secrezione artero-venosa. Quando un'AVM si rompe, si formano più spesso ematomi intracerebrali e subdurali. Il passaggio di sangue nelle cisterne subaracnoidee è secondario. L'emorragia dalla parete rotta dell'AVM si arresta più rapidamente, poiché la pressione sanguigna al suo interno è inferiore rispetto alle arterie principali e la parete è più suscettibile alla compressione del sangue fuoriuscito. Naturalmente, questo non sempre finisce bene per il paziente. Le rotture di AVM più pericolose si verificano in prossimità dei ventricoli cerebrali, nei gangli sottocorticali e nel tronco encefalico. L'angiospasmo delle arterie afferenti in questa situazione contribuisce ad arrestare l'emorragia.
Il fattore determinante nella patogenesi della rottura di una MAV è il volume di sangue versato e la localizzazione dell'ematoma. Gli ematomi intracerebrali emisferici, anche con un volume fino a 60 cm³ , hanno un decorso relativamente favorevole. Possono causare gravi disturbi neurologici focali, ma raramente portano a gravi disturbi vitali. La rottura di un ematoma nei ventricoli cerebrali peggiora significativamente la prognosi. Da un lato, il sangue, irritando l'ependima dei ventricoli, aumenta la produzione di liquido cerebrospinale, dall'altro, colpendo la parte inferiore del ventricolo, porta a gravi disturbi delle funzioni dei centri vitali situati nell'ipotalamo. La diffusione del sangue in tutto il sistema ventricolare porta al tamponamento di quest'ultimo, che di per sé è incompatibile con la vita.
Il sangue che penetra nelle cisterne subaracnoidee interrompe anche la circolazione del liquido cerebrospinale, rendendo difficile il suo raggiungimento delle granulazioni di Pacchion ostruite dal sangue. Di conseguenza, il riassorbimento del liquido cerebrospinale rallenta e può svilupparsi un'ipertensione liquorale acuta, seguita da idrocefalo interno ed esterno. A seguito della degradazione degli elementi figurati del sangue versato, si forma un gran numero di sostanze tossiche, la maggior parte delle quali ha un effetto vasoattivo. Da un lato, ciò porta alla vasocostrizione delle piccole arterie piali e, dall'altro, aumenta la permeabilità capillare. I prodotti di degradazione del sangue influenzano anche le cellule nervose, alterandone i processi biochimici e interrompendo la permeabilità delle membrane cellulari. Innanzitutto, la funzione della pompa potassio-sodio cambia e il potassio inizia a lasciare la cellula, e il catione sodio, quattro volte più idrofilo del potassio, si precipita a prenderne il posto.
Ciò porta prima a un edema intracellulare nell'area circostante l'emorragia e poi a un rigonfiamento delle cellule. Anche l'ipossia contribuisce allo sviluppo di edema, che inevitabilmente si aggiunge a causa della compressione dei vasi cerebrali da parte dell'ematoma e dell'aumento della pressione del liquido cerebrospinale, come già detto. La disfunzione delle parti diencefaliche del cervello e, soprattutto, della regolazione dell'equilibrio idroelettrolitico porta a ritenzione idrica nell'organismo e perdita di potassio, che a sua volta aumenta la reazione edematosa del cervello. La patogenesi della rottura di MAV non si limita ai disturbi cerebrali. Non meno pericolose sono le complicanze extracerebrali. In primo luogo, si tratta della sindrome cerebrocardica, che sull'elettrocardiogramma può simulare un'insufficienza coronarica acuta.
I pazienti con emorragie intracerebrali sviluppano rapidamente polmonite e insufficienza respiratoria. Inoltre, la flora batterica svolge un ruolo secondario. L'effetto primario è l'influenza centrale sui polmoni, consistente in broncospasmo diffuso, aumento della produzione di espettorato e muco, ischemia del parenchima polmonare dovuta a spasmo diffuso delle piccole arterie polmonari, che porta rapidamente a disturbi distrofici, desquamazione dell'epitelio alveolare e riduzione della funzione di scambio gassoso polmonare.
Se a ciò si accompagna la soppressione del riflesso della tosse, ovvero un'insufficienza respiratoria di tipo bulbare, si pone un grave rischio per la vita del paziente. Nella maggior parte dei casi, la trachiobronchite purulenta che ne consegue è difficilmente trattabile con la terapia antibiotica e aggrava l'insufficienza respiratoria, che si riflette immediatamente sull'aumento dell'ipossia cerebrale. Pertanto, la violazione della respirazione esterna, anche in presenza di una relativa compensazione dei disturbi cerebrali, può avere un esito fatale. Spesso, i pazienti dopo il coma riprendono conoscenza, ma poi muoiono a causa dell'aggravarsi dell'insufficienza respiratoria e dell'edema cerebrale ipossico.
Le alterazioni distrofiche si sviluppano rapidamente non solo nei polmoni, ma anche nel fegato, nel tratto gastrointestinale, nelle ghiandole surrenali e nei reni. Infezioni delle vie urinarie e piaghe da decubito, che si sviluppano rapidamente in assenza di cure adeguate, rappresentano una minaccia per la vita del paziente. Ma queste complicazioni possono essere evitate se i medici le ricordano e sanno come combatterle.
Riassumendo l'esame della patogenesi della rottura di MAV, va sottolineato che la mortalità in tali emorragie intracraniche è inferiore a quella della rottura di aneurismi arteriosi e degli ictus emorragici ipertensivi, sebbene raggiunga il 12-15%. Le MAV sono caratterizzate da emorragie ripetute, a volte multiple, con periodicità variabile, impossibile da prevedere. In caso di decorso sfavorevole del periodo post-emorragico, i meccanismi patogenetici elencati possono portare a un esito fatale.
Sintomi malformazione arterovenosa
Forma emorragica della malattia (50-70% dei casi). Questa forma è caratterizzata dalla presenza di ipertensione arteriosa nel paziente, dalle piccole dimensioni del nodulo malformativo, dal suo drenaggio nelle vene profonde e dalla frequente presenza di malformazioni artero-venose della fossa cranica posteriore.
La forma emorragica è il primo sintomo di manifestazione di una malformazione artero-venosa nel 50% dei casi, causando un esito dettagliato nel 10-15% dei casi e disabilità nel 20-30% dei pazienti (N. Martin et al.). Il rischio annuo di emorragia nei pazienti con malformazione artero-venosa è dell'1,5-3%. Il rischio di emorragie ripetute durante il primo anno raggiunge l'8% e aumenta con l'età. Il sanguinamento da malformazione artero-venosa è la causa del 5-12% di tutta la mortalità materna e del 23% di tutte le emorragie intracraniche nelle donne in gravidanza. Un quadro di emorragia subaracnoidea si osserva nel 52% dei pazienti. Nel 17% dei pazienti si verificano forme complicate di emorragia: formazione di ematomi intracerebrali (38%), subdurali (2%) e misti (13%), e si sviluppa emotamponamento ventricolare nel 47%.
Il decorso torpido è tipico dei pazienti con grandi malformazioni artero-venose localizzate nella corteccia. L'afflusso di sangue alla malformazione artero-venosa è fornito da rami dell'arteria cerebrale media.
I sintomi più caratteristici del decorso di tipo torpido sono la sindrome convulsiva (nel 26-27% dei pazienti con malformazione arterovenosa), la cefalea a grappolo e il deficit neurologico progressivo, come nei tumori cerebrali.
Varianti delle manifestazioni cliniche delle malformazioni artero-venose
Come già accennato, la prima manifestazione clinica più comune di MAV è l'emorragia intracranica spontanea (40-60% dei pazienti). Spesso si verifica senza alcun sintomo premonitore, in condizioni di salute ottimali. Momenti scatenanti possono essere lo sforzo fisico, situazioni stressanti, tensione neuropsichica, l'assunzione di dosi elevate di alcol, ecc. Al momento della rottura della MAV, i pazienti avvertono un improvviso e acuto mal di testa, simile a un colpo o a una rottura. Il dolore aumenta rapidamente, causando vertigini, nausea e vomito.

La perdita di coscienza può verificarsi entro pochi minuti. In rari casi, il mal di testa può essere lieve, i pazienti non perdono conoscenza, ma avvertono indebolimento e intorpidimento degli arti (solitamente controlaterali all'emorragia) e difficoltà di parola. Nel 15% dei casi, l'emorragia si manifesta come una crisi epilettica conclamata, dopo la quale i pazienti possono rimanere in stato comatoso.
Per determinare la gravità dell'emorragia da MAV, si può utilizzare la scala Hunt-Hess sopra riportata, con alcuni aggiustamenti. Poiché le emorragie da MAV possono presentare sintomi molto diversi, i sintomi neurologici focali possono prevalere sui sintomi cerebrali generali. Pertanto, i pazienti con livelli di coscienza ai livelli I o II della scala possono presentare gravi disturbi neurologici focali (emiparesi, emiipestesia, afasia, emianopsia). A differenza delle emorragie aneurismatiche, la rottura della MAV non è determinata dalla gravità e dalla prevalenza dell'angiospasmo, ma dal volume e dalla localizzazione dell'ematoma intracerebrale.
La sindrome meningea si sviluppa dopo diverse ore e la sua gravità può variare. La pressione sanguigna di solito aumenta, ma non così bruscamente e per una durata minore rispetto alla rottura degli aneurismi arteriosi. Solitamente, questo aumento non supera i 30-40 mmHg. Al secondo o terzo giorno, compare ipertermia di origine centrale. Le condizioni dei pazienti peggiorano naturalmente con l'aumento dell'edema cerebrale e l'intensificazione della disgregazione del sangue versato. Questo fenomeno persiste fino a 4-5 giorni. Con un decorso favorevole, dopo la stabilizzazione al 6-8° giorno, le condizioni dei pazienti iniziano a migliorare. La dinamica dei sintomi focali dipende dalla localizzazione e dalle dimensioni dell'ematoma.
In caso di emorragia in aree cerebrali funzionalmente importanti o di distruzione dei conduttori motori, i sintomi di perdita compaiono immediatamente e persistono a lungo senza alcuna dinamica. Se i sintomi di perdita non compaiono immediatamente, ma aumentano parallelamente all'edema cerebrale, ci si può aspettare una reintegrazione del deficit in 2-3 settimane, con la completa regressione dell'edema.
Il quadro clinico della rottura di una MAV è molto vario e dipende da molti fattori, i principali dei quali sono: il volume e la sede dell'emorragia, la gravità della reazione di edema cerebrale e il grado di coinvolgimento delle strutture del tronco encefalico nel processo.
Le malformazioni artero-venose possono manifestarsi come crisi epilettiformi (30-40%). La causa del loro sviluppo può essere rappresentata da disturbi emocircolatori nelle aree cerebrali limitrofe dovuti al fenomeno del furto. Inoltre, la malformazione stessa può irritare la corteccia cerebrale, generando scariche epilettiche. Abbiamo già parlato di alcuni tipi di MAV, attorno ai quali si sviluppa la gliosi del tessuto cerebrale, che si manifesta spesso anche con crisi epilettiche.
Una sindrome epilettica causata dalla presenza di una MAV è caratterizzata dalla sua insorgenza senza causa in età adulta, spesso in completa assenza di un fattore scatenante. Le crisi possono essere generalizzate o focali. La presenza di una chiara componente focale in una crisi epilettica in assenza di sintomi cerebrali generali dovrebbe far sospettare la presenza di una possibile MAV. Anche le crisi generalizzate, se iniziano con convulsioni principalmente agli stessi arti con rotazione forzata della testa e degli occhi da un lato o dall'altro, sono spesso una manifestazione di una MAV. Meno frequentemente, i pazienti manifestano crisi minori come assenze o stato di coscienza crepuscolare. La frequenza e la periodicità delle crisi epilettiche possono variare: da isolate a ricorrenti.
Forme
VV Lebedev e coautori hanno identificato tre varianti della sindrome cerebrocardica sulla base dei dati ECG:
- Tipo I - violazione delle funzioni di automatismo ed eccitabilità (tachicardia o bradicardia sinusale, aritmia, fibrillazione atriale);
- Tipo II - alterazioni nei processi di ripolarizzazione, alterazioni transitorie nella fase finale del complesso ventricolare a seconda del tipo di ischemia, danno miocardico con alterazioni dell'onda T e della posizione del tratto ST;
- Tipo III - disturbo della funzione di conduzione (blocco, segni di sovraccarico del cuore destro). Queste alterazioni ECG possono essere combinate e la loro gravità è correlata alla gravità delle condizioni generali dei pazienti.
Complicazioni e conseguenze
Una malformazione artero-venosa (MAV) è un'anomalia vascolare congenita in cui arterie e vene sono collegate senza uno strato capillare interposto. Le complicazioni e le conseguenze delle MAV possono essere gravi e dipendono dalle dimensioni, dalla posizione e dalle caratteristiche della specifica malformazione. Tra queste, ricordiamo:
- Ictus: una delle complicanze più gravi delle MAV è il rischio di ictus. Le malformazioni possono creare percorsi anomali per il flusso sanguigno, che possono portare a emorragie cerebrali e, di conseguenza, a ictus. L'ictus può avere diversi gradi di gravità e lasciare deficit neurologici residui.
- Epilessia: le MAV possono causare crisi epilettiche in alcuni pazienti, soprattutto se la malformazione è localizzata in determinate aree del cervello.
- Emorragia: le malformazioni possono essere imprevedibili e causare emorragie cerebrali. Questa può essere una complicazione potenzialmente letale e portare a gravi conseguenze.
- Idrocefalo: se l'AVM si trova vicino ai ventricoli cerebrali, può causare idrocefalo, che può portare all'accumulo di liquido in eccesso nel cervello e all'aumento della pressione intracranica.
- Deficit neurologici: una MAV può danneggiare il tessuto cerebrale circostante e causare diversi deficit neurologici, tra cui paralisi, disturbi sensoriali e deficit nella coordinazione motoria e del linguaggio.
- Dolore e mal di testa: i pazienti affetti da MAV possono avvertire dolore cronico e mal di testa correlati alla malformazione.
- Effetti psicologici: le complicazioni derivanti dalle MAV possono avere un impatto significativo sul benessere psicologico dei pazienti, tra cui ansia, depressione e stress.
- Limitazioni dello stile di vita: una volta rilevata una MAV, i pazienti potrebbero aver bisogno di modificare lo stile di vita e di adottare misure di gestione del rischio, tra cui limitare l'attività fisica e determinate attività.
Diagnostica malformazione arterovenosa
La diagnosi di una malformazione artero-venosa (MAV) in genere prevede una serie di esami di diagnostica per immagini per confermare la presenza e valutarne le caratteristiche. I principali metodi utilizzati per diagnosticare una MAV sono:
- Angiografia a risonanza magnetica (ARM): l'ARM è uno dei metodi principali per la diagnosi delle MAV. È un esame non invasivo che visualizza la struttura dei vasi sanguigni e il flusso sanguigno nel cervello utilizzando campi magnetici e onde radio. L'ARM può determinare la posizione, le dimensioni e la forma della MAV.
- Angiografia a sottrazione digitale (DSA): si tratta di una procedura più invasiva che prevede l'iniezione di un mezzo di contrasto direttamente nei vasi attraverso un catetere e l'utilizzo di raggi X per produrre immagini di alta qualità dei vasi cerebrali. La DSA consente un esame più dettagliato della struttura della MAV e del flusso sanguigno.
- Tomografia computerizzata (TC): la TC può essere utilizzata per rilevare le MAV e valutare possibili complicanze, come il sanguinamento. Se necessario, può essere utilizzato un mezzo di contrasto per migliorare la visualizzazione.
- Ecografia vascolare duplex (ecografia duplex): questa tecnica può essere utile per esaminare i vasi del collo e della testa e identificare disturbi del flusso sanguigno associati alle MAV.
- Spettroscopia a risonanza magnetica (MRS): la MRS può fornire informazioni sulla composizione chimica dei tessuti nell'area dell'AVM e rivelare segni di cambiamenti metabolici.
- Ecoencefalografia: è un esame ecografico che può essere utilizzato per valutare il flusso sanguigno e la struttura del cervello.
- Angiografia tomografica computerizzata (CTA): la CTA combina la TC e l'angiografia per produrre immagini tridimensionali dei vasi sanguigni nel cervello.
Una volta diagnosticata una MAV, è importante eseguire una valutazione dettagliata delle caratteristiche della malformazione, come dimensioni, forma e gravità. Questo aiuterà a determinare se è necessario un trattamento e la migliore opzione terapeutica, tra cui la rimozione chirurgica, l'embolizzazione, la radioterapia o l'osservazione. La decisione di trattare una MAV deve essere presa in collaborazione tra il paziente e l'équipe sanitaria, tenendo conto delle circostanze individuali di ciascun caso.
Diagnosi differenziale
La diagnosi differenziale delle malformazioni artero-venose (MAV) può essere un passo importante nella valutazione di un paziente con alterazioni vascolari cerebrali. Le MAV sono anomalie vascolari in cui arterie e vene sono connesse senza uno strato capillare intermedio. Possono causare una varietà di sintomi e condizioni, e differenziarle da altri disturbi vascolari è importante per un trattamento adeguato. Alcune condizioni che possono richiedere una diagnosi differenziale con le MAV includono:
- Ictus: gli ictus possono simulare i sintomi di una MAV, soprattutto se causati da alterazioni vascolari. La distinzione può richiedere una tomografia computerizzata (TC) o una risonanza magnetica (RM) dell'encefalo per visualizzare le alterazioni vascolari.
- Ematoma: gli ematomi, come l'ematoma subdurale o epidurale, possono simulare i sintomi di una MAV, soprattutto se accompagnati da mal di testa e sintomi neurologici. Una TC o una risonanza magnetica possono aiutare a determinare la causa dei sintomi.
- Tumori cerebrali: i tumori cerebrali possono causare una varietà di sintomi che possono essere simili a quelli di una MAV. La diagnosi può includere la risonanza magnetica con contrasto e altri esami di diagnostica per immagini.
- Emicrania: l'emicrania con aura può simulare i sintomi delle MAV, come disturbi visivi e vertigini. L'anamnesi e ulteriori esami possono aiutare a distinguere le due condizioni.
- Vasculite cerebrale: la vasculite può causare infiammazione dei vasi sanguigni e anomalie vascolari che possono simulare i sintomi di una MAV. La biopsia o l'angiografia possono essere utilizzate per diagnosticare la vasculite.
- Trombosi venosa: le trombosi venose possono simulare i sintomi di una MAV, soprattutto se si verifica un'interruzione del deflusso venoso dal cervello. Ulteriori studi possono aiutare a identificare la trombosi.
Per una diagnosi differenziale accurata delle MAV, l'indagine comprende un esame clinico approfondito, metodi neuroeducativi (TC, RM, angiografia), talvolta una biopsia e altre procedure specialistiche a seconda dei sintomi e delle circostanze specifiche.
Chi contattare?
Trattamento malformazione arterovenosa
Il trattamento di una malformazione artero-venosa (MAV) dipende dalle sue dimensioni, dalla sua posizione, dai sintomi e dalle potenziali complicanze. In alcuni casi, una MAV può essere piccola e asintomatica e potrebbe non richiedere un trattamento attivo. Tuttavia, in presenza di sintomi o di rischio di sanguinamento, potrebbe essere necessario un trattamento. Alcuni dei trattamenti per le MAV includono:
- Chirurgia: la rimozione chirurgica della MAV può essere presa in considerazione nei casi in cui la malformazione si trovi in una sede accessibile e sia di bassa complessità. La rimozione chirurgica può aiutare a prevenire il rischio di sanguinamento e a ridurre i sintomi. Si tratta di una procedura complessa e può comportare rischi come danni ai tessuti e ai nervi circostanti.
Interventi aperti (transcranici):
- Stadio I - coagulazione degli afferenti;
- Stadio II - isolamento del nucleo della malformazione arterovenosa;
- Stadio III - legatura e coagulazione dell'efferente e rimozione della malformazione artero-venosa,
Interventi endovascolari:
- occlusione con palloncino stazionario delle arterie nutritizie - embolizzazione in-flow (incontrollata);
- combinazione di occlusione temporanea o permanente del palloncino con embolizzazione in-flow;
- embolizzazione superselettiva.
Le malformazioni artero-venose vengono trattate anche con la radiochirurgia (Gamma-knife, Cyber-knife, Linac, ecc.).
- Embolizzazione: l'embolizzazione è una procedura che prevede l'inserimento di materiali medicali o colla nei vasi sanguigni per bloccare il flusso sanguigno verso la MAV. L'embolizzazione può essere utilizzata come fase preparatoria prima dell'intervento chirurgico o come trattamento a sé stante. Può contribuire a ridurre il sanguinamento e le dimensioni della MAV.
- Radioterapia: la radioterapia può essere utilizzata per trattare le MAV, soprattutto nei casi in cui altri trattamenti potrebbero essere troppo rischiosi. La radioterapia mira a ridurre il sanguinamento della MAV e può richiedere più sedute.
- Farmaci: in alcuni casi, i farmaci possono essere utilizzati per ridurre sintomi come dolore o crampi. Possono anche essere utilizzati per controllare la pressione sanguigna e ridurre il rischio di sanguinamento.
- Osservazione e gestione dei sintomi: in alcune situazioni, soprattutto se l'AVM è piccola e non provoca sintomi, si può decidere di osservare semplicemente la condizione e gestire i sintomi secondo necessità.
Il trattamento delle MAV deve essere personalizzato per ogni paziente e la scelta del metodo dipende dalle circostanze specifiche. È importante discutere tutte le opzioni terapeutiche con un professionista sanitario ed effettuare una valutazione approfondita del paziente per determinare il piano terapeutico migliore. I risultati del trattamento possono essere positivi e i pazienti possono ottenere un miglioramento o una completa guarigione, ma ogni caso è unico.
Previsione
La prognosi di una malformazione artero-venosa (MAV) dipende da diversi fattori, tra cui le dimensioni, la posizione, i sintomi, l'età del paziente e il successo del trattamento. È importante ricordare che una MAV è una condizione medica che può presentarsi in modo diverso in pazienti diversi e che la prognosi può variare da persona a persona. Ecco alcuni aspetti generali della prognosi di una MAV:
- Rischio di sanguinamento: il rischio principale di una MAV è il rischio di sanguinamento (emorragia) cerebrale. Le MAV di piccole dimensioni con un basso rischio di sanguinamento possono avere una buona prognosi e non causare problemi gravi. Tuttavia, le MAV di grandi e medie dimensioni possono rappresentare un rischio significativo.
- Sintomi: i sintomi associati a una MAV, come mal di testa, convulsioni, paralisi o disturbi sensoriali, possono influenzare la prognosi. In alcuni casi, un trattamento efficace può migliorare o eliminare i sintomi.
- Dimensioni e sede: le MAV localizzate in sedi più pericolose, come quelle profonde nel cervello o in prossimità di strutture critiche, possono avere una prognosi peggiore. Tuttavia, anche molte MAV di grandi dimensioni possono essere trattate con successo.
- Trattamento: il trattamento delle MAV può includere la rimozione chirurgica, l'embolizzazione, la radioterapia o la terapia farmacologica. Un trattamento efficace può ridurre il rischio di sanguinamento e migliorare la prognosi.
- Età: anche l'età del paziente può influenzare la prognosi. Bambini e giovani adulti hanno spesso una prognosi migliore rispetto ai pazienti più anziani.
- Comorbidità: la presenza di altre condizioni mediche o fattori di rischio, come ipertensione o disturbi emorragici, può influenzare la prognosi e il trattamento dell'AVM.
È importante sottolineare che la MAV richiede un attento monitoraggio medico e un trattamento adeguato. La decisione sul metodo di trattamento e sulla prognosi deve essere presa da neurochirurghi e neuroradiologi qualificati, sulla base di un'attenta valutazione di ogni singolo caso.

