
Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
Sindrome dell'ovaio policistico.
Esperto medico dell'articolo
Ultima recensione: 04.07.2025
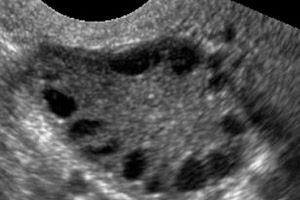
La sindrome dell'ovaio policistico è una patologia multifattoriale eterogenea caratterizzata da disturbi del ciclo mestruale, anovulazione cronica, iperandrogenismo, alterazioni cistiche ovariche e infertilità. La sindrome dell'ovaio policistico è caratterizzata da obesità moderata, mestruazioni irregolari o amenorrea e sintomi da eccesso di androgeni (irsutismo, acne). Le ovaie solitamente contengono numerose cisti. La diagnosi si basa su test di gravidanza, livelli ormonali ed esami per escludere un tumore virilizzante. Il trattamento è sintomatico.
Le cause sindrome dell'ovaio policistico
La sindrome dell'ovaio policistico è una patologia endocrina comune dell'apparato riproduttivo, che si verifica nel 5-10% delle pazienti; è caratterizzata da anovulazione ed eccesso di androgeni a eziologia sconosciuta. Le ovaie possono essere di dimensioni normali o ingrossate, con una capsula liscia e ispessita. Di norma, le ovaie contengono numerose piccole cisti follicolari di 26 mm; a volte si riscontrano cisti di grandi dimensioni contenenti cellule atresiche. I livelli di estrogeni aumentano, il che porta a un aumento del rischio di iperplasia endometriale e, in ultima analisi, di cancro dell'endometrio. I livelli di androgeni sono spesso aumentati, il che aumenta il rischio di sindrome metabolica e irsutismo.
 [ 13 ]
[ 13 ]
Patogenesi
Le donne con sindrome dell'ovaio policistico (PCOS) presentano anomalie nel metabolismo degli androgeni e degli estrogeni, e una ridotta sintesi di androgeni. La malattia è accompagnata da elevate concentrazioni sieriche di ormoni androgeni come testosterone, androstenedione, deidroepiandrosterone solfato e DHEA-S. Tuttavia, a volte è possibile riscontrare livelli normali di androgeni.
La PCOS è anche associata a insulino-resistenza, iperinsulinemia e obesità. L'iperinsulinemia può anche portare alla soppressione della sintesi di SHBG, che a sua volta può aumentare le caratteristiche androgeniche.
Inoltre, la resistenza all'insulina nella PCOS è associata all'adiponectina, un ormone secreto dagli adipociti che regola il metabolismo dei lipidi e i livelli di glucosio nel sangue.
L'aumento dei livelli di androgeni è accompagnato da un aumento dell'effetto stimolante dell'ormone luteinizzante (LH) secreto dall'ipofisi anteriore, che porta alla crescita delle cellule della teca ovarica. Queste cellule, a loro volta, aumentano la sintesi di androgeni (testosterone, androstenedione). A causa di un livello ridotto di ormone follicolo-stimolante (FSH) rispetto a LH, le cellule granulari ovariche non riescono ad aromatizzare gli androgeni in estrogeni, il che porta a una diminuzione dei livelli di estrogeni e alla successiva anovulazione.
Alcune prove suggeriscono che i pazienti presentano una compromissione funzionale del citocromo P450c17, 17-idrossilasi, che inibisce la biosintesi degli androgeni.
La sindrome dell'ovaio policistico è una sindrome geneticamente eterogenea. Studi su familiari affetti da PCOS dimostrano un'ereditarietà autosomica dominante. Recentemente, è stata confermata un'associazione genetica tra PCOS e obesità. Una variante del gene FTO (rs9939609, che predispone all'obesità generalizzata) è significativamente associata alla suscettibilità allo sviluppo della PCOS. Sono stati identificati polimorfismi del locus 2p16 (2p16.3, 2p21 e 9q33.3) associati alla sindrome dell'ovaio policistico, così come il gene che codifica per il recettore dell'ormone luteinizzante (LH) e della gonadotropina corionica umana (hCG).
Sintomi sindrome dell'ovaio policistico
I sintomi della sindrome dell'ovaio policistico iniziano durante la pubertà e diminuiscono con il tempo. La presenza di mestruazioni regolari per un certo periodo dopo il menarca esclude la diagnosi di sindrome dell'ovaio policistico. L'esame obiettivo rivela solitamente un muco cervicale abbondante (che riflette alti livelli di estrogeni). La diagnosi di sindrome dell'ovaio policistico può essere sospettata se una donna presenta almeno due sintomi tipici (obesità moderata, irsutismo, mestruazioni irregolari o amenorrea).
La combinazione più comune di sintomi clinici è:
- disturbi del ciclo mestruale (oligomenorrea, sanguinamento uterino disfunzionale, amenorrea secondaria);
- anovulazione;
- infertilità;
- irsutismo;
- disturbo del metabolismo dei grassi (obesità e sindrome metabolica);
- diabete;
- sindrome dell'apnea notturna ostruttiva.
Cosa ti infastidisce?
Diagnostica sindrome dell'ovaio policistico
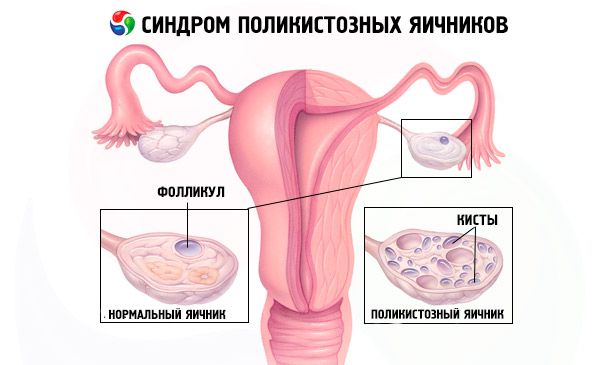
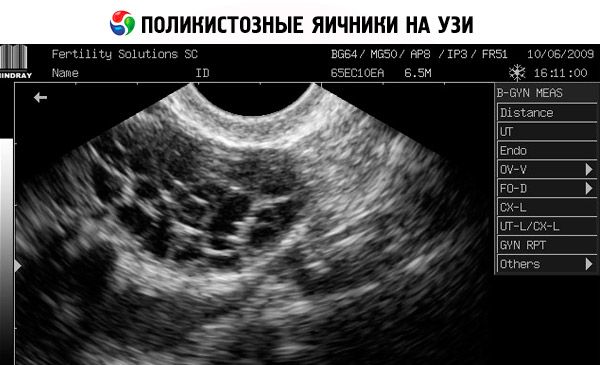
La diagnosi si basa sull'esclusione della gravidanza (test di gravidanza) e sulla valutazione di estradiolo, FSH, TSH e prolattina nel siero. La diagnosi è confermata dall'ecografia, che rivela la presenza di più di 10 follicoli nell'ovaio; i follicoli si trovano solitamente in periferia e assomigliano a una collana di perle. Se si notano follicoli nelle ovaie e irsutismo, è necessario determinare i livelli di testosterone e DHEAS. I livelli patologici vengono valutati come nell'amenorrea.
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
Anamnesi ed esame fisico
Raccogliendo attentamente l'anamnesi, si identificano i fattori ereditari per lo sviluppo della sindrome dell'ovaio policistico. Durante l'esame, vengono calcolati l'indice di massa corporea e il rapporto vita-fianchi (normalmente ≤ 0,8) per diagnosticare sovrappeso e obesità.
La sindrome dell'ovaio policistico è caratterizzata dal polimorfismo dei segni clinici e di laboratorio.
Metodi diagnostici speciali per la sindrome dell'ovaio policistico
È obbligatorio uno studio ormonale tra il 3° e il 5° giorno della reazione simil-mestruale: vengono determinati i livelli ematici di LH, FSH, prolattina, testosterone, androgeni surrenalici - DHEAS, 17-idrossiprogesterone. La sindrome dell'ovaio policistico è caratterizzata da un elevato indice LH/FSH -> 2,5–3 (dovuto a un aumento dei livelli di LH) e iperandrogenismo.
Per chiarire l'origine dell'iperandrogenismo, viene eseguito un test con ACTH per la diagnosi differenziale con l'iperandrogenismo causato da una mutazione del gene che codifica per l'enzima 21-idrossilasi nelle ghiandole surrenali (diagnosi delle forme latenti e latenti della sindrome adrenogenitale). Tecnica: alle ore 9:00, viene prelevato un campione di sangue dalla vena cubitale, quindi viene somministrato 1 mg del farmaco Synacthen Depot per via intramuscolare e dopo 9 ore viene effettuato un nuovo prelievo. Si determina la concentrazione di cortisolo e 17-idrossiprogesterone in entrambe le porzioni di sangue, quindi si calcola un coefficiente utilizzando una formula speciale, i cui valori non devono superare 0,069. In questi casi, il test è negativo e la donna (o l'uomo) non è portatrice della mutazione del gene 21-idrossilasi.
Il test della difenina viene eseguito per rilevare forme centrali di sindrome dell'ovaio policistico e valutare la possibilità di un trattamento con farmaci neurotrasmettitoriali. Tecnica del test: si determina la concentrazione iniziale di LH e testosterone nel sangue, quindi si assume 1 compressa di difenina 3 volte al giorno per 3 giorni, dopodiché si determina nuovamente la concentrazione degli stessi ormoni nel sangue. Il test è considerato positivo se i livelli di LH e testosterone diminuiscono.
- L'ecografia dei genitali rivela ovaie ingrossate (10 cm3 o più), follicoli multipli fino a 9 mm di diametro, ispessimento dello stroma ovarico e ispessimento della capsula.
- Inoltre, se si sospetta una resistenza all'insulina, viene eseguito un test di tolleranza al glucosio per determinare i livelli di insulina e glucosio prima e dopo l'esercizio fisico.
- Se si sospetta una genesi surrenalica della sindrome dell'ovaio policistico, si raccomandano consulenza genetica e genotipizzazione HLA.
- Isterosalpingografia.
- Laparoscopia.
- Valutazione della fertilità dello sperma del coniuge.
Nel novembre 2015, l'American Association of Clinical Endocrinologists (AACE), l'American College of Endocrinology (ACE) e l'Androgen Excess and PCOS Society (AES) hanno pubblicato nuove linee guida per la diagnosi di PCOS. Queste linee guida sono:
- I criteri diagnostici per la PCOS devono includere uno dei tre criteri seguenti: anovulazione cronica, iperandrogenismo clinico e malattia dell'ovaio policistico.
- Oltre ai risultati clinici, per diagnosticare la PCOS è necessario misurare i livelli sierici di 17-idrossiprogesterone e di ormone antimulleriano.
- I livelli di testosterone libero sono più sensibili nel rilevare l'eccesso di androgeni rispetto ai livelli di testosterone totale.
Cosa c'è da esaminare?
Chi contattare?
Trattamento sindrome dell'ovaio policistico
Alle donne con cicli mestruali anovulatori (storia di mestruazioni assenti o irregolari e nessuna evidenza di produzione di progesterone), senza irsutismo e senza desiderio di rimanere incinte, viene somministrato un progestinico intermittente (ad esempio, medrossiprogesterone da 5 a 10 mg per via orale una volta al giorno per 10-14 giorni al mese per 12 mesi) o contraccettivi orali per ridurre il rischio di iperplasia e cancro dell'endometrio e per diminuire i livelli di androgeni circolanti.
Nelle donne con sindrome dell'ovaio policistico con cicli anovulatori, irsutismo e che non pianificano una gravidanza, il trattamento è mirato a ridurre l'irsutismo e a regolare i livelli sierici di testosterone e DHEAS. Le donne che desiderano una gravidanza si sottopongono a trattamenti per l'infertilità.
Il trattamento dell'infertilità nella sindrome dell'ovaio policistico si svolge in 2 fasi:
- Fase 1 - preparatoria;
- Fase 2 – stimolazione dell’ovulazione.
La terapia nella fase preparatoria dipende dalla forma clinica e patogenetica della sindrome dell'ovaio policistico.
- Nei casi di sindrome dell'ovaio policistico e obesità, si consiglia di prescrivere farmaci che aiutino a ridurre la resistenza all'insulina: il farmaco di scelta è la metformina, assunta per via orale alla dose di 500 mg 3 volte al giorno per 3-6 mesi.
- Nella forma ovarica della sindrome dell'ovaio policistico e con alti livelli di LH, vengono utilizzati farmaci che aiutano a ridurre la sensibilità del sistema ipotalamo-ipofisario alla soppressione completa della funzione ovarica (livello sierico di estradiolo < 70 pmol/l):
- spray buserelin, 150 mcg in ciascuna narice 3 volte al giorno dal 21° o 2° giorno del ciclo mestruale, ciclo 1–3 mesi, oppure
- deposito di buserelin per via intramuscolare 3,75 mg una volta ogni 28 giorni dal 21° o 2° giorno del ciclo mestruale, ciclo 1–3 mesi, oppure
- leuprorelina per via sottocutanea 3,75 mg una volta ogni 28 giorni dal 21° o 2° giorno del ciclo mestruale, ciclo 1–3 mesi, oppure
- triptorelina per via sottocutanea 3,75 mg una volta ogni 28 giorni o 0,1 mg una volta al giorno dal 21° o 2° giorno del ciclo mestruale, ciclo di 1–3 mesi.
In linea di principio, non importa a partire dal giorno (21 o 2) del ciclo mestruale in cui vengono prescritti gli agonisti del GnRH; tuttavia, è preferibile la prescrizione a partire dal 21° giorno, poiché in questo caso non si formano cisti ovariche. Quando vengono prescritti a partire dal 2° giorno del ciclo, la fase di attivazione che precede la fase di soppressione del meccanismo d'azione dell'agonista del GnRH coincide con la fase follicolare del ciclo e può causare la formazione di cisti ovariche.
Farmaci alternativi:
- etinilestradiolo/dienogest per via orale 30 mcg/2 mg una volta al giorno dal 5° al 25° giorno del ciclo mestruale, ciclo 3–6 mesi o
- etinilestradiolo/acetato di ciproterone per via orale 35 mcg/2 mg una volta al giorno dal 5° al 25° giorno del ciclo mestruale, ciclo di 3-6 mesi.
- Nella forma surrenalica della sindrome dell'ovaio policistico, la somministrazione di farmaci glucocorticoidi è indicata:
- desametasone per via orale 0,25–1 mg una volta al giorno, ciclo 3–6 mesi, oppure
- metilprednisolone per via orale 2–8 mg una volta al giorno, ciclo 3–6 mesi, oppure
- prednisolone per via orale 2,5–10 mg una volta al giorno, ciclo di 3–6 mesi.
- Per la forma centrale della sindrome dell'ovaio policistico si utilizzano gli anticonvulsivanti:
- difenina 1 compressa per via orale 1-2 volte al giorno;
- carbamazepina per via orale 100 mg 2 volte al giorno, ciclo di 3-6 mesi.
Nella seconda fase si effettua la stimolazione dell'ovulazione.
La scelta dei farmaci e i relativi schemi di somministrazione vengono determinati tenendo conto dei dati clinici e di laboratorio. Durante l'induzione dell'ovulazione, vengono eseguiti un attento monitoraggio ecografico e ormonale del ciclo stimolato.
È inaccettabile indurre l'ovulazione con qualsiasi farmaco senza monitoraggio ecografico. È inappropriato iniziare l'induzione dell'ovulazione in presenza di formazioni cistiche nelle ovaie con un diametro > 15 mm e uno spessore endometriale > 5 mm.
L'induzione dell'ovulazione con clomifene è indicata nelle donne giovani con una breve storia della malattia e livelli sufficienti di estrogeni (estradiolo sierico < 150 pmol/l) e bassi livelli di LH (> 15 UI/l).
Il clomifene viene prescritto per via orale alla dose di 100 mg una volta al giorno dal 5° al 9° giorno del ciclo mestruale, alla stessa ora del giorno.
Un'ecografia di controllo viene eseguita il 10° giorno del ciclo per valutare il diametro del follicolo dominante e lo spessore dell'endometrio. Gli esami vengono eseguiti a giorni alterni, nel periodo periovulatorio, quotidianamente. Non è il giorno del ciclo che conta, ma le dimensioni del follicolo dominante: se il suo diametro è superiore a 16 mm, è necessario eseguire un'ecografia giornaliera fino a raggiungere i 20 mm.
Regimi terapeutici alternativi (con pronunciato effetto antiestrogenico):
Schema 1:
- clomifene per via orale 100 mg 1 volta al giorno dal 5° al 9° giorno del ciclo mestruale alla stessa ora del giorno +
- etinilestradiolo (EE) per via orale 50 mcg 2 volte al giorno dal 10° al 15° giorno del ciclo mestruale o
- estradiolo per via orale 2 mg 2 volte al giorno dal 10° al 15° giorno del ciclo mestruale.
Schema 2:
- clomifene per via orale 100 mg 1 volta al giorno dal 3° al 7° giorno del ciclo mestruale alla stessa ora del giorno +
- menotropine per via intramuscolare 75–150 UI una volta al giorno alla stessa ora dal 7°–8° giorno del ciclo mestruale o
- follitropina alfa per via intramuscolare 75–150 UI una volta al giorno alla stessa ora a partire dal 7°–8° giorno del ciclo mestruale.
L'induzione dell'ovulazione con citrato di clomifene non è indicata nelle seguenti situazioni:
- nell'ipoestrogenismo (livello sierico di estradiolo < 150 pmol/l);
- dopo una preparazione preliminare con agonisti del GnRH (a causa della ridotta sensibilità del sistema ipotalamo-ipofisi-ovaio, si sviluppa ipoestrogenismo);
- Nelle donne in età riproduttiva avanzata, con una lunga storia di malattia e livelli sierici di LH elevati (> 15 UI/L), è inappropriato aumentare la dose di clomifene a 150 mg/die durante cicli di stimolazione ripetuti, poiché aumenta l'effetto antiestrogenico periferico negativo.
Si sconsiglia di effettuare più di 3 cicli consecutivi di stimolazione con clomifene; se il trattamento non risulta efficace, si deve ricorrere alle gonadotropine.
La stimolazione dell'ovulazione con gonadotropine è indicata in assenza di un'adeguata follicologenesi dopo stimolazione con clomifene, in presenza di un pronunciato effetto antiestrogenico periferico o di una saturazione estrogenica insufficiente. Può essere eseguita sia in pazienti giovani che in età riproduttiva avanzata.
Farmaci di scelta:
- menotropine per via intramuscolare 150–225 UI una volta al giorno dal 3° al 5° giorno del ciclo mestruale alla stessa ora, corso 7–15 giorni o
- urofollitropina per via intramuscolare 150–225 UI una volta al giorno dal 3° al 5° giorno del ciclo mestruale alla stessa ora, per un ciclo di 7–15 giorni.
Farmaci alternativi (per l'alto rischio di sviluppare la sindrome da iperstimolazione ovarica):
- Follitropina alfa per via intramuscolare 100-150 UI una volta al giorno dal 3° al 5° giorno del ciclo mestruale alla stessa ora, per un ciclo di 7-15 giorni. L'induzione dell'ovulazione con gonadotropine utilizzando analoghi del GnRH è indicata in presenza di sindrome dell'ovaio policistico con elevati livelli di LH nel siero (> 15 UI/L).
Farmaci di scelta:
- buserelin sotto forma di spray da 150 mcg in ciascuna narice 3 volte al giorno a partire dal 21° giorno del ciclo mestruale oppure
- buserelin depot per via intramuscolare 3,75 mg una volta il 21° giorno del ciclo mestruale;
- leuprorelina per via sottocutanea 3,75 mg una volta il 21° giorno del ciclo mestruale;
- triptorelina per via sottocutanea 3,75 mg una volta il 21° giorno del ciclo mestruale o 0,1 mg una volta al giorno dal 21° giorno del ciclo mestruale +
- menotropine per via intramuscolare 225–300 UI una volta al giorno dal 2° al 3° giorno del ciclo mestruale successivo alla stessa ora.
Farmaci alternativi (per l'alto rischio di sviluppare la sindrome da iperstimolazione ovarica):
- menotropine per via intramuscolare 150–225 UI una volta al giorno dal 2° al 3° giorno del ciclo mestruale alla stessa ora o
- follitropina alfa per via intramuscolare 150–225 UI una volta al giorno dal 2° al 3° giorno del ciclo mestruale alla stessa ora +
- ganirelix per via sottocutanea 0,25 mg una volta al giorno, a partire dal 5°-7° giorno di utilizzo della gonadotropina (quando il follicolo dominante raggiunge una dimensione di 13-14 mm);
- cetrorelix per via sottocutanea 0,25 mg una volta al giorno, a partire dal 5°-7° giorno di utilizzo delle gonadotropine (quando il follicolo dominante raggiunge una dimensione di 13-14 mm).
Induzione dell'ovulazione in pazienti in età riproduttiva tardiva (con debole risposta ovarica ai farmaci gonadotropi).
Farmaci di scelta:
- menotropine per via intramuscolare 225 UI una volta al giorno dal 3° al 5° giorno del ciclo mestruale alla stessa ora +
- triptorelina per via sottocutanea 0,1 mg una volta al giorno a partire dal 2° giorno del ciclo mestruale.
Farmaci alternativi:
- triptorelina per via sottocutanea 0,1 mg una volta al giorno dal 2° giorno del ciclo mestruale +
- follitropina alfa per via intramuscolare 200–225 UI una volta al giorno dal 3° al 5° giorno del ciclo mestruale alla stessa ora.
In tutti gli schemi che utilizzano gonadotropine, l'adeguatezza della dose di queste ultime viene valutata in base alla dinamica di crescita del follicolo (normalmente 2 mm/giorno). In caso di crescita lenta dei follicoli, la dose viene aumentata di 75 UI, mentre in caso di crescita troppo rapida, viene ridotta di 75 UI.
In tutti gli schemi, se è presente un follicolo maturo di 18-20 mm e lo spessore dell'endometrio è di almeno 8 mm, la terapia viene interrotta e viene somministrata per via intramuscolare una dose singola di 10.000 UI di gonadotropina corionica umana.
Dopo la conferma dell'ovulazione, si supporta la fase luteale del ciclo.
Farmaci di scelta:
- didrogesterone per via orale 10 mg 1-3 volte al giorno, ciclo 10-12 giorni o
- Progesterone per via orale 100 mg 2-3 volte al giorno, o per via vaginale 100 mg 2-3 volte al giorno, o per via intramuscolare 250 mg 1 volta al giorno, ciclo di 10-12 giorni. Farmaco alternativo (in assenza di sintomi di iperstimolazione ovarica):
- gonadotropina corionica umana per via intramuscolare 1500–2500 UI una volta al giorno nei giorni 3,5 e 7 della fase luteale.
Altri farmaci utilizzati nel trattamento della PCOS:
- Antiandrogeni (ad esempio spironolattone, leuprolide, finasteride).
- Farmaci ipoglicemizzanti (ad esempio metformina, insulina).
- Modulatori selettivi del recettore degli estrogeni (ad esempio, citrato di clomifene).
- Farmaci per l'acne (ad esempio, perossido di benzoile, crema alla tretinoina (0,02-0,1%)/gel (0,01-0,1%)/soluzione (0,05%), crema all'adapalene (0,1%)/gel (0,1%, 0,3%)/soluzione (0,1%), eritromicina 2%, clindamicina 1%, solfetamide sodica 10%).
Effetti collaterali del trattamento
Con l'uso di clomifene, la maggior parte delle pazienti sviluppa un effetto antiestrogenico periferico, che consiste in un ritardo nella crescita endometriale rispetto a quella follicolare e in una riduzione della quantità di muco cervicale. Con l'uso di gonadotropine, in particolare gonadotropina umana menopausale (menotropine), può svilupparsi una sindrome da iperstimolazione ovarica (OHSS); con l'uso di FSH ricombinante (follitropina alfa), il rischio di sindrome da iperstimolazione ovarica è inferiore. Con l'uso di regimi terapeutici che includono agonisti del GnRH (triptorelina, buserelina, leuprorelina), il rischio di sindrome da iperstimolazione ovarica aumenta e l'uso di agonisti del GnRH può causare sintomi da carenza di estrogeni: vampate di calore, secchezza della pelle e delle mucose.
Previsione
L'efficacia del trattamento dell'infertilità nella sindrome dell'ovaio policistico dipende dalle caratteristiche cliniche e ormonali del decorso della malattia, dall'età della donna, dall'adeguatezza della terapia preparatoria e dalla corretta selezione del regime di induzione dell'ovulazione.
Nel 30% delle giovani donne con una storia breve della malattia, è possibile ottenere una gravidanza dopo un trattamento preparatorio senza indurre l'ovulazione.
L'efficacia della stimolazione dell'ovulazione con clomifene non supera il 30% per donna; il 40% delle pazienti con sindrome dell'ovaio policistico è resistente al clomifene.
L'uso di menotropine e urofollitropina consente di ottenere una gravidanza nel 45-50% delle donne, ma questi farmaci aumentano il rischio di sviluppare la sindrome da iperstimolazione ovarica.
I più efficaci sono gli schemi che utilizzano agonisti del GnRH, che permettono di evitare picchi "parassitari" di LH: fino al 60% delle gravidanze per donna. Tuttavia, l'uso di questi farmaci comporta il rischio più elevato di complicanze: forme gravi di sindrome da iperstimolazione ovarica e gravidanze multiple. L'uso di antagonisti del GnRH non è meno efficace, ma non è associato a un rischio elevato di sindrome da iperstimolazione ovarica.
 [ 34 ]
[ 34 ]

